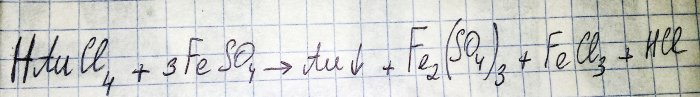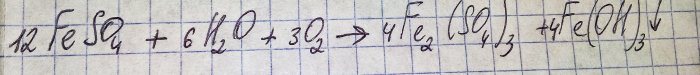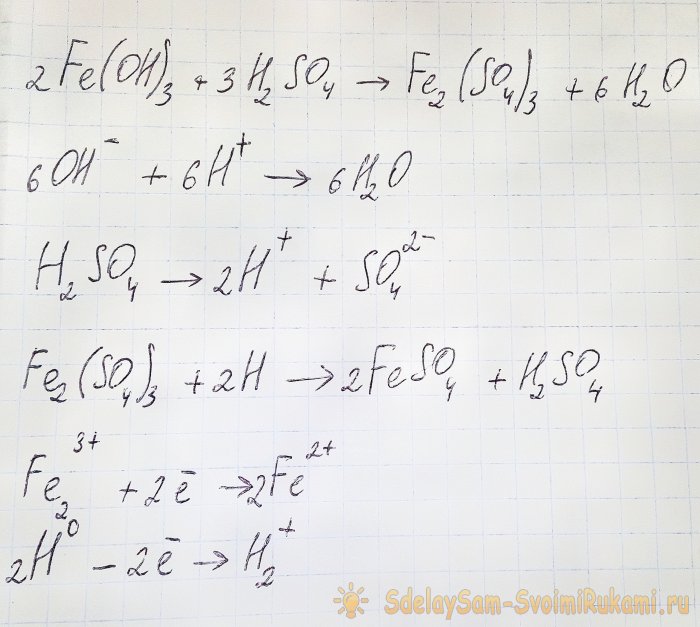Предпоследним этапом на пути получения благородного металла из радиодеталей является восстановление последнего из соответствующего хлорида. Для этих целей отлично подходит сульфат железа(II). Рассмотрим уравнение данной реакции:
HAuCl4 - тетрахлораурат (III) водорода - соединение, которое образуется при растворении золота в царской водке. Углубляться в этот процесс пока не будем, так как он заслуживает отдельной статьи.
Итак, сульфат (здесь и далее подразумевается сульфат железа(II)) является одним из дешёвых и легкодоступных восстановителей. В магазинах его можно встретить под названием «железный купорос», это удобрение. Но это не чистое вещество, доля сульфата в нём составляет около 50%, остальное - примеси. И прежде чем восстанавливать золото, необходимо очистить наш сульфат.
Понадобится
Для этого понадобится:
- Железный купорос (продаётся в магазинах по типу «всё для дачи»; я купил килограмм, чтоб с головой хватило);
- Раствор серной кислоты, он же кислотный электролит для аккумуляторов (в автомагазинах);
- Спирт, я использовал 95%;
- Химическая, либо одноразовая посуда (стаканчики, ложки для размешивания).
Получаем сульфат железа из удобрения
Для приготовления раствора я использую стеклянную банку. Внутри 500мл горячей воды, можно чуть меньше.
Теперь отмеряем около половины стакана удобрения:
Как видно, вещество жёлто-коричневого цвета, использовать такой грязный «сульфат» можно разве что по назначению - опрыскивать растительность. У нас же другие цели.
Засыпаем его в банку:
Раствор приобрёл неприятный коричневый цвет. Окрашивание произошло за счёт реакции удобрения с водой:
Железо в сульфате окисляется до трёхвалентного, и в осадок выпадает гидроксид железа(III), собственно из-за него такой цвет.
Чтобы из образовавшихся соединений получить интересующий нас сульфат, необходимо раствор подкислить серной кислотой. Добавляем мелкими порциями, пока раствор не посветлеет.
При этом протекают следующие реакции:
Гидроксид взаимодействует с кислотой, и при этом образуется сульфат железа(III) (реакция ионного обмена). Он в свою очередь реагирует с атомарным водородом, который образуется при диссоциации серной кислоты. Последняя реакция окислительно-восстановительная.
Теперь в растворе находится именно нужный нам сульфат, но сам раствор по-прежнему мутный. Даём ему отстояться и фильтруем его, я использовал химический фильтр.
На дне банки остались нерастворимые примеси:
Промываем её и переливаем туда отфильтрованный раствор. Он гораздо светлее и чище изначального.
Этиловый спирт вытесняет соли двухосновных кислот из их растворов. Этим свойством мы и воспользуемся для получения твёрдого сульфата. Приливаем к раствору спирт, я залил 200мл, что по объему равно чуть больше половины от изначального объёма удобрения.
На дне появились кристаллики нашего сульфата.
Я оставил раствор на двое суток, чтобы весь сульфат успел выпасть в осадок.
Можно изначально залить больше спирта, чтобы этот процесс проходил быстрее.
Сливаем жидкость, при помощи постукиваний по дну и несильного нагревания отделяем сульфат от банки и высыпаем его на бумажное полотенце для просушки.
Через несколько часов пересыпаем сульфат в стеклянную банку, подписываем вещество, и в таком виде его можно хранить длительное время.
Так как в осадок выпали кристаллогидраты, формула вещества как на картинке. Но это никак не мешает нам использовать его для своих целей, всё равно растворять в воде.
Заключение
Техника безопасности и соблюдение правил обращения с кислотами - само собой разумеющееся. Ни в коем случае не забываем о них.
Всем чистых веществ!